Apersepsi :
Saat kalian melihat batuan yang tidak biasa, cangkang hewan laut yang bagus, kristal salju, daun yang memerah, karat, plastisin, kuku, rambut, bahkan juga kertas, kapas, sirup, nata de coco, atau compact disk (CD) dan baterei isi ulang, Kalian mungkin pernah bertanya terbuat dari apakah benda – benda ini?
Tahukah Kalian pertanyaan itu telah menggelitik manusia sejak lama. Sejak dulu orang telah bertanya, menduga, dan memperkirakan apa yang menyusun benda – benda di sekitarnya, dan juga tubuhnya sendiri.
Bangsa Yunani kuno percaya bahwa segala sesuatu tersusun atas empat unsur dasar, yaitu air, udara, tanah, dan api. Sifat setiap benda tergantung bagaimana komposisi unsur – unsur ini disusun.
Pada abad ke – 17, seorang ilmuwan Inggris, Robert Boyle, mengemukakan bahwa setiap unsur tersusun atas partikel yang sederhana, dan tidak tersusun atas unsur yang lain. Pernyataan inilah yang mendasari berkembangnya konsep atom, penyusun unsur, hingga sekarang. Kita akan mempelajari bagaimana konsep atom berkembang dari yang paling sederhana hingga konsep yang kita terima sekarang dalam bab ini.
untuk sejarah ditemukannya atom kalian bisa menonton video ini dulu yaa, anak- anak..
Perkembangan Teori Atom
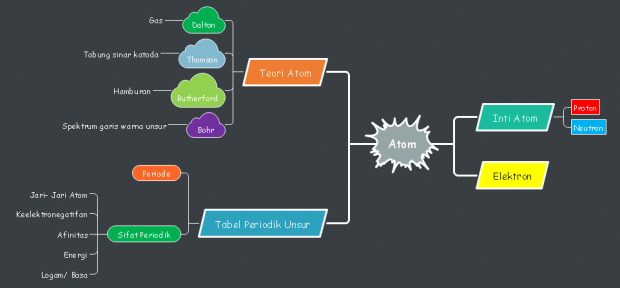
Teori atom telah lama berkembang mulai pada beberapa abad sebelum Masehi. Teori ini telah menjadi pertanyaan besar di kalangan para ahli filsafat Yunani. Democritus (460 – 370 SM) berpendapat bahwa suatu materi tersusun atas partikel yang tak dapat dibagi. Pemikirannya kira – kira sebagai berikut: bila kamu membelah suatu benda, sepotong coklat misalnya, kemudian kamu bagi lagi potongan kecil ini, lagi, lagi, lagi, dan lagi maka suatu saat kamu akan mendapatkan potongan kecil, bahkan sangat kecil, yang tidak dapat kamu belah lagi. Oleh karena itu materi tersusun atas partikel – partikel yang tidak dapat dibagi yang disebut atomos.
Berbeda dengan Democritus, Aristotle lebih percaya bahwa setiap benda terusun atas empat unsur dasar dan menurutnya materi bersifat kontinu, yang berarti akan terus menerus dapat dibelah. Karena Aristotle lebih berpengaruh, pendapat Aristotle ini lebih banyak dianut orang dan konsep atomos terpendam selama hampir 2000 tahun!
Setelah munculnya pendapat dari Robert Boyle, berkembang teori atom yang lebih didasarkan pada eksperimen hingga munculnya teori atom yang dikemukakan oleh John Dalton.
- John Dalton (Tahun 1805)
Teori atom Dalton dianggap sebagai puncak dari usaha-usaha penelitian yang dilakukan oleh para kimiawan. Dalton dapat menyatukan berbagai fakta dan teori kedalam suatu teori tentang sifat materi. Teori yang dikemukakan berdasarkan asumsi-asumsi berikut:
- semua unsur terdiri atas partikel yang sangat kecil yang disebut atom. Atom adalah penyusun utama setiap benda
- semua atom dari unsur tertentu sama, dan memiliki masa atom yang sama pula.
- Atom dari unsur yang berbeda juga berbeda dalam hal massa dan volumenya
- Atom tidak dapat dimusnahkan atau diubah saat bereaksi
- Atom-atom dari satu unsur dapat bergabung dengan atom-atom dari unsur lain untuk membentuk molekul, satuan dasar dari senyawa
- Perbandingan atom dalam molekul selalu tetap dan dapat dinyatakan dalam bilangan bulat dan sederhana (Gebelein, 1997)
Telah disepakati bersama bahwa setiap benda tersusun atas partikel sederhana yang paling kecil yang tidak dapat dibagi lagi. Sekarang dapatkah Kalian bayangkan seperti apakah partikel terkecil ini? Bagaimanakah bentuknya? Seperti kotak, kubus, kerucut, segitiga, lingkaran, bulat, bentuk lainnya, atau sama sekali tak beraturan?
Bulat seperti bola! Mungkin Kalian berfikir demikian dan fikiran inilah yang muncul pada John Dalton, seorang guru berkebangsaan Inggris. Tapi, mengapa bola? Karena bola memiliki luas permukaan yang paling kecil dibandingkan dengan bentuk yang lain untuk volume yang sama. Bentuk ini pula yang sering dipilih oleh benda-benda di alam.
Tidak percaya?

sumber : http://ayana-nurti.blogspot.com/2012/?m=0
Mari kita buktikan, buatlah daftarlah nama – nama buah yang kalian tahu dan hitung jumlah buah yang bulat (atau cenderung bulat) dan hitung pula yang berbentuk lain. Mana yang lebih banyak?
Atau kalian mungkin sering memperhatikan butiran embun, atau air yang menempel di jendela saat hari sangat dingin atu hujan. Coba juga teteskan air (ingat, hanya diteteskan) dari ketinggian dua meter, lihatlah bentuk tetesan air saat dia bergerak ke bawah

sumber : dokumentasi
Gambar. Tetesan-tetesan air dan embun di daun yang membulat membentuk luas bidang sentuh seminimal mungkin. Bulat juga merupakan bentuk yang paling mudah diingat untuk menggambarkan atom
untuk lebih jelasnya, simak video berikut yaa :
Teori atom Dalton ini memiliki beberapa kelemahan, diantaranya:
a. Tidak dapat menjelaskan sifat listrik materi.
b. Tidak dapat menjelaskan cara atom-atom saling berikatan.
c. Model atom Dalton tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan unsur yang lain.
2. J.J. Thomson (Tahun 1879)
Pada abad ke-19 berkembang penemuan tentang listrik, listrik dan materi berhubungan.
Apakah Kalian pernah menggosokkan penggaris plastik pada rambut kemudian didekatkan pada sobekan – sobekan kecil kertas, atau bulu halus di tangan? Atau mungkin Kalian mau mencobanya lagi sekarang?
Apa yang terjadi saat penggaris itu didekatkan pada kertas atau tangan kalian?
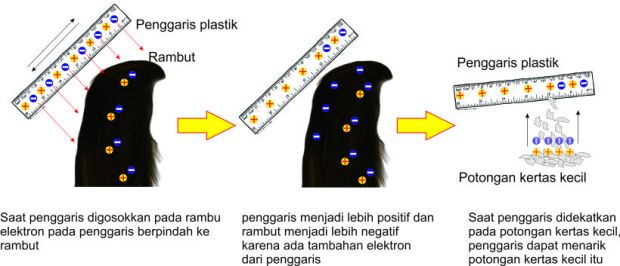
Ini adalah gejala listrik yang sudah dikenal orang sejak lama. Selain itu telah lama dikenal bahwa aliran listrik dapat menguraikan senyawa menjadi unsur – unsurnya.
Para ahli mulai mencoba berbagai cara untuk menyelidiki sifat – sifat listrik ini. Untunglah Michael Faraday (1791-1867) menemukan tabung sinar katoda. Faraday menemukan tabung sinar katoda dengan melewatkan listrik dalam tabung gelas yang telah divacumkan. Sinar tersebut merupakan radiasi yang dipancarkan oleh terminal negatif atau katoda melewati tabung vakum menuju terminal positif atau anoda.
Sinar katoda bergerak secara garis lurus dan sifat-sifatnya tidak bergantung dari jenis materialnya. Sinar katoda merupakan sinar tak terlihat yang hanya dapat dideteksi dari cahaya yang dipancarkan oleh material yang dikenainya. Misalnya dengan cara melapisi dinding tabung dengan ZnS yang disebut fluoresens.
Salah satu yang menarik dari sinar katoda adalah dapat dibelokkan oleh suatu medan listrik atau medam magnet sebagaimana sifat partikel-partikel bermuatan negatif.

Gambar sinar katoda bergerak lurus dari katoda ke anoda
Pada tahun 1897 dengan menggunakan metode yang sama, J.J. Thomson (18561940) menentukan rasio massa (m) terhadap muatan listrik (e) untuk sinar katode.
Berdasarkan Rasio m/e, Thomson menyimpulkan bahwa sinar katode merupakan partikel dasar bermuatan negatif penyusun suatu atom. Sinar katode kemudian dikenal sebagai elektron, yaitu istilah pertama kali diusulkan George Stoney pada tahun 1874.
Jumlah muatan positif = jumlah muatan negatif

untuk penjelasan lebih lanjut, kalian bisa menyimak video berikut ya :
Teori :
- Atom merupakan bola masif/ pejal yang bermuatan positif.
- Pada tempat-tempat tertentu terdapat elektron-elektron yang bermuatan negatif.
Kelemahan : Tidak dapat menjelaskan dinamika reaksi kimia yang terjadi antar atom.
3. Ernest Rutherford (Tahun 1911)
Pada saat J.J. Thomson mengemukakan model atomnya, dia telah menyatakan gagasan tentang adanya muatan positif dalam atom. Hanya saja Thomson belum bisa menjelaskan lebih rinci mengenai muatan positif ini. Gagasan tentang muatan positif ini mulai mendapatkan titik terang saat Rutherford murid Thomson, meneliti tentang inti atom.
Pada tahun 1911, Rutherford bersama kedua mahasiswanya (Geiger dan Ernest Marsden) melakukan percobaan dengan melakukan percobaan dengan menembak lapisan tipis emas menggunakan partikel – α. Rutherford melakukan penelitiannya dengan cara menembak lapisan tipis emas menggunakan pertikel – α. Hasil penelitiannya telah menunjukkan bahwa muatan positif atom seluruhnya terpusat pada inti atom.
Setelah mengatahui hal ini, Rutherford memfokuskan penelitiannya mengenai inti atom. Meskipun Rutherford telah mengamati adanya muatan positif pada inti atom, baru pada tahun 1919 ia menemukan partikel positif tersebut dan selanjutnya dinamakan proton.
Rutherford telah berhasil menemukan proton, tetapi dia masih menemukan kejanggalan dalam struktur atom. Hal ini dilihatnya pada atom hidrogen dan helium. Hidrogen mempunyai satu proton, sedangkan helium mempunyai dua proton.
Dengan mengabaikan massa elektron yang sangat kecil, seharusnya perbandingan massa antara hidogen dan helium adalah 1 : 2. Namun pada kenyataannya perbandingan massa antara hidrogen dan helium adalah 1 : 4. Ruterford kemudian menduga bahwa dalam inti atomterdapat partikel lain yang bermuatan netral dan memiliki massa yang hampir sama dengan proton.
Baru pada tahun 1932, dugaan Rutherford menjadi kenyataan , yaitu setelah James Chadwick (1891-1972) menembak lapisan tipis berilium dengan partikel α, yang menghasilkan pancaran radiasi energi yang sangat tinggi sebanding dengan radiasi sinar –γ keluar dari logam tersebut. Kemudian Chadwick menamainya netron, karena partikel ini tidak bermuatan (netral) dan memiliki massa sedikit lebih besar dari proton.
Nah, untuk lebih jelasnya mungkin kalian bisa menyimak video ini ya:
Teori:
- Sebagian besar massa dan seluruh muatan positif yang terdapat dalam atom terpusat di wilayah yang sangat kecil yang disebut inti atom. Atom itu sendiri sebagian besar merupakan ruangan kosong
- Besarnya muatan positif adalah berbeda antar satu atom dengan atom lainnya
- Banyaknya elektron di sekitar inti atom sama dengan banyaknya muatan positif pada inti atom. Atom itu sendiri secara keseluruhan bersifat netral (Σ p = Σ e)
Kelemahan : Jika elektron bergerak mengelilingi inti akibatnya energi akan berkurang sehingga elektron akan jatuh ke inti atom (kenyataan atom bersifat stabil).
4. Niels Bohr (Tahun 1914)
Model atom Rutherford belum menjelaskan bagaimana elektron-elektron tersusun disekeliling inti atom. Menurut hukum fisika klasik, elektron yang bermuatan negatif di sekeliling inti atom saling tarik menarik dengan inti atom yang bermuatan positif. Oleh karena itu, elektron akan terus bergerak mengelilingi inti atom seperti planet-planet mengelilingi matahari. Tarik menarik antara elektron dengan inti atom semakin mempercepat pergerakan elektron. Elektron akan memancarkan energi selama pergerakannya . lambat laun elektron akan terpilin semakin mendekati inti dan akhirnya jatuh ke inti atom. Akan tetapi hal ini tidak sesuai dengan kenyataan bahwa elektron di dalam atom tidak pernnah jatuh ke inti atom.
Pada tahun 1913 Fisikawan muda dari Denmark, Neils Bohr pertama kali mengembangkan teori struktur atom dan menggambarkan tingkat energi elektron di dalam atom.
Bohr mengusulkan elektron itu dalam suatu atom dapat berada hanya pada tingkat energi tertentu.
Video berikut bisa membantu kalian untuk memahami teori Bohr dengan lebih baik, cek yaa
Teori :
- Elektron bergerak pada orbit melingkar mengelilingi inti dengan pergerakan yang mengikuti hukum fisika klasik
- Elektron menduduki orbit tertentu yang disebut kondisi stasioner dan selama elektron berada pada orbitnya, maka energinya akan tetap dan tidak memancarkan energi apapun
- Elektron dapat berpindah naikdan turn dari satu orbit ke orbit lainnya . Selama elektron mengalami proses transisi ini, sejumlah paket energi tertentu akan dihasilkan atau dibutuhkan. Artinya, elektron dapat berpindah dari tingkat enrgi terendah ke tingkat energi yang lebih tinggi dengan cara menyerap energi tertentu. Sebaliknya, ketika elektron ke tingkat energi terendahnya, energi yang sama akan dibebaskan
Kelemahan :
- Tidak dapat menjelaskan mengapa elektron yang mengelilingi inti tidak jatuh ke inti.
- Tidak dapat menjelaskan letak elektron dengan pasti.
Lebih lanjut mengenai teori atom Bohr terutama mengenai proses transisi elektron dari satu orbit ke orbit lainnya akan di bahas di kelas 2. Pahamilah teori atom Bohr, supaya kamu tidak mengalami kesulitan di kelas 2 nanti
4. Teori Mekanika Gelombang
Menurut Louis de Broglie, materi dapat bersifat sebagai partikel dan gelombang (sifat dualisme). Karena sifat dualisme ini, maka letak maupun kecepatan elektron tidak bisa dipastikan. Keadaan inipun dikenal dengan istilah prinsip ketidapastian Heisenberg. Kemudian diketahui bahwa lintasan elektron bukan melingkar seperti yang digambarkan Niels Bohr namun mengikuti pola gelombang yang diam.
Seorang ilmuan dari Austria bernama Schrödinger membuat perhitungan matematika untuk menjelaskan lintasan elektron atau orbital. Kemudian dihasilkan 3 bilangan yang mampu mendeskripsikan orbital elektron menjadi lebih jelas.
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama digunakan untuk menentukan besarnya tingkat energi elektron yang digunakan untuk mencirikan ukuran orbital. Didapatkan bahwa bilangan n ini adalah bilangan bulat dari 1 hingga tidak terhingga. Misalnya n=1, maka terletak di kulit K, n=2 maka terletak di kulit L, n=3 maka terletak di kulit M.
2. Bilangan Kuantum Azimut (l)
Bilangan ini disebut juga sebagai momentum sudut yang bisa memberi informasi tentang bagaimana bentuk orbital. Nilainya tergantung pada nilai kunatum utama (n). Nilai n tertentu akan menghasilakan bilangan l dari nol hinga n-1.
Misalnya n=1 menjadi 1-1=0, subkulit ini dilampangkan dengan huruf s. Sedangkan n=2 menjadi 2-1=1, subkulit ini dilambangkan dengan huruf p. Jika n=3 menjadi 3-1=2, subkulit ini dilambangkan dengan huruf d. Dan jika n=4 menjadi 4-1=3, subkulit ini dilambangkan dengan huruf d.
3. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik dapat menentukan arah orientasi dari suatu orbital di dalam sebuah ruang, dan relatif terhadap orbital lainnya. Bilangan ini dapat ditunjukkan dengan meletakkan spektrum garis suatu atom tertentu ke dalam medan magnet lalu menghasilkan spektrum tambahan.
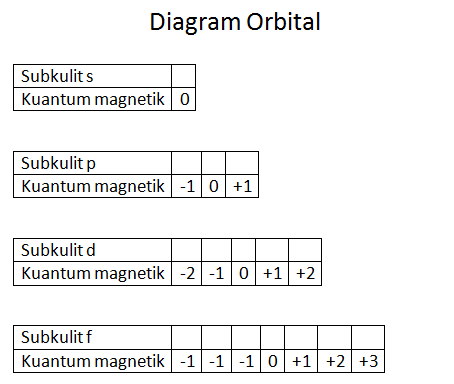
4. Bilangan Kuantum Spin (s)
Bilangan kuantum spin adalah bilangan kuantum yang tidak terpengaruh momentum sudut. Nilai bilangan kuantum spin yaitu +1/2 atau -1/2.
Kelebihan Teori Atom Mekanika Gelombang
Mampu membuktikan bahwa adanya lintasan elektron untuk atom hidrogen
Kelemahan Teori Atom Mekanika Gelombang
Hanya dapat menerangkan atom-atom yang memiliki elektron tunggal seperti gas hidrogen tetapi tidak dapat menerangkan spektrum warna dari atom yang memiliki banyak elektron.
Sumber :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.
Setyawati, Arifatun Anifah.2009.Kimia : Mengkaji Fenomena Alam Untuk Kelas X SMA/MA. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Harnanto, Ari dan Ruminten.2009. Kimia 1 : Untuk SMA/MA Kelas X.Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Utami, Budi dkk.Kimia 1 : Untuk SMA/MA Kelas X. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Permana, Irvan.2009.Memahami Kimia 1 : SMA/MA untuk kelas X, semester 1 dan 2.Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Khamidinal, Tri Wahyuningsih dan Shidiq Premono.2009.Kimia : SMA/MA Kelas X. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Sunarya, Yayan dan Agus Setiabudi.2009. Mudah dan Aktif Belajar Kimia 2 : Untuk Kelas XI Sekolah Menengah Atas/Madrasah Aliyah Program Ilmu Pengetahuan Alam.Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Partana, Crys Fajar dan Antuni Wiyarsi.2009.Mari Belajar Kimia 2 : Untuk SMA XI IPA. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Internet
https://www.jakartanotebook.com/baterai-18650-14-days-multi-color
https://www.libgar.com/2017/12/jenis-jenis-batuan.html
http://campuraduksglhal.blogspot.com/2015/11/cara-merawat-tanaman-pucuk-merah.html
https://materikimia.com/kelebihan-dan-kelemahan-teori-atom-modern-mekanika-gelombang-mekanika-kuantum/https://www.siswapedia.com/teori-atom-dan-mekanika-kuantum/
https://www.bukalapak.com/p/hobi-koleksi/mainan/mainan-lainnya/1esy31-jual-lilin-mainan-plastisin-besar-bola-11x6x5cm
https://www.bukalapak.com/p/hobi-koleksi/berkebun/bibit-tanaman/50nlfe-jual-biji-benih-tanaman-kapas-gossypium
https://cookpad.com/id/cari/minuman%20nata%20de%20coco?page=18
http://dederusnadi.blogspot.com/2011/05/sejarah-penemuan-cd-compact-disc-dan.html
http://harga-kardus.blogspot.com/p/harga-kardus-terbaru.html
https://www.bukalapak.com/p/industrial/industrial-lainnya/cwkly5-jual-cetak-kemasan-es-serut-pelangi-kertas-kerucut
http://media.rooang.com/2017/06/rak-sepatu-unik-dan-kreatif-dari-kardus-bekas/
https://hanyasetengah.blogspot.com/2014/05/tokoh-tokoh-fisika-penemu-atom.html
https://cahyokrisma.wordpress.com/2015/08/12/darimana-listrik-muncul/
https://hanyasetengah.blogspot.com/2014/05/tokoh-tokoh-fisika-penemu-atom.htmlhttp://tiaraveronica.blogspot.com/












